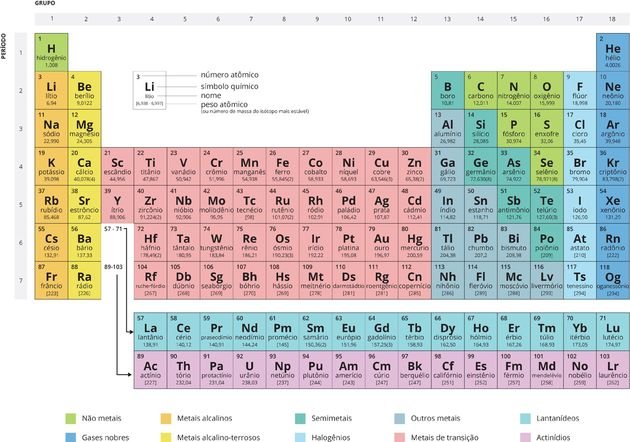
Tabela periódica
A tabela tem os elementos químicos dispostos em ordem crescente de número atômico e são divididos em grupos (ou famílias) devido a características que são comuns entre eles. Cada elemento químico é representado por um símbolo, por exemplo a prata é representada por Ag devido a seu nome no latim argentum. Cada elemento possui ao lado de seu símbolo o número atômico e o número de massa.
Número atômico
O número atômico é utilizado para determinar a
quantidade de prótons e elétrons de um átomo e permite identificar um elemento
químico.
Número atômico é o código matemático utilizado como registro de
identidade de cada elemento químico existente,
ou seja, é o numeral que identifica um átomo como um elemento específico.
Convencionou-se a letra Z maiúscula
para representar esse número em
qualquer situação (texto, exercício, etc).
Quando
representamos o átomo de um elemento químico, seu número atômico é
escrito sempre do lado esquerdo, na região inferior, como podemos observar no
exemplo geral abaixo:
ZX
Na tabela periódica, a identificação do número atômico pode ser feita facilmente por ele ser o menor número presente no quadrado do elemento, já que o outro número (maior) refere-se à massa atômica do elemento.
Menor número presente no
quadrado indica o número atômico do elemento
Outra importância do número atômico é
que, em 1913, Moseley organizou a tabela periódica por
ordem crescente desse número. Assim, é possível verificar que apenas o número
atômico aumenta de forma inteira e consecutiva na tabela.
A identificação do número
atômico na tabela periódica utiliza a sequência de números inteiros e
consecutivos
Ter acesso ao número atômico em
texto, exercício ou diretamente na tabela possibilita-nos saber diversas
informações fundamentais sobre o átomo de um elemento, como:
·
Número de prótons no interior do núcleo;
·
Número de elétrons presentes na eletrosfera;
·
Conhecendo o número de elétrons do átomo, podemos
realizar a sua distribuição eletrônica e, consequentemente, saber seus
subníveis mais energéticos e mais externos;
·
Determinar o número de nêutrons no interior do núcleo do átomo, se também
conhecermos o número de massa do átomo, que pode ser obtido pela expressão
abaixo:
A = Z + n
ou
n
= A – Z
A=
Massa
Z=
Numero atômico(prótons, elétrons)
N=
Nêutrons
Essa fórmula
também pode ser utilizada para determinar o número atômico, porém, para isso, devemos conhecer o
número de massa e o número de nêutrons.
Exemplo da
utilização do número
atômico de
um elemento químico:
Elemento: ouro
(Au)
Destaques das informações do
ouro na tabela periódica
Entre as informações desse elemento presentes na
tabela, estão os valores 79 e 196,97. Portanto, o número atômico do ouro é 79.
A partir de seu número atômico, sabemos que o elemento:
·
Possui 79 prótons no núcleo;
·
Possui 79 elétrons nas eletrosferas.
Períodos e Famílias da Tabela Periódica
Os períodos e as famílias
da Tabela Periódica são, respectivamente, as colunas horizontais e verticais
nas quais os elementos químicos estão organizados.
Classificação dos elementos
- Metais: São bons condutores de calor e eletricidade. São sólidos nas CNTP (com exceção do mercúrio), além de maleáveis e dúcteis.
- Não metais: São maus condutores de corrente elétrica e calor. Podem assumir qualquer estado físico na temperatura ambiente.
- Gases nobres: Apresentam baixa reatividade, sendo até pouco tempo considerados inertes.
Os elementos podem ser classificados em representativos ou de transição (interna e externa). Os representativos são aqueles cuja distribuição eletrônica termina em s ou p. Os elementos de transição externa são aqueles cuja distribuição acaba em d, e os de transição interna acabam em f. A localização de um elemento na tabela periódica pode ser indicada pelo seu grupo e seu período. Os elementos de transição interna são os que se encontram nas duas linhas bem embaixo na tabela e na verdade é como se estivessem localizados no no sexto e sétimo período do grupo três.
Cada linha no sentido horizontal da tabela periódica representa um período. Eles são em número de sete, e o período em que o elemento se encontra indica o número de níveis que possui. Por exemplo o sódio (Na) está no período três, o que significa que o seu átomo possui três camadas eletrônicas.
Já os grupos são as linhas verticais que apresentam elementos químicos que compartilham propriedades. Por exemplo o flúor (F) e o cloro (Cl) estão no grupo 17 (ou 7A) por possuírem alta tendência de receber elétrons, o que chamamos de eletronegatividade. Alguns grupos possuem nomes específicos como os listados abaixo e os demais recebem o nome do primeiro elemento de seu grupo.
Grupo 1: Metais alcalinos: esses elementos são muito reativos principalmente com a água. Esta reatividade aumenta conforme aumenta o número atômico e o raio do átomo. Todos os elementos desse grupo são eletropositivos, metais bons condutores de eletricidade, e formam bases fortes. São sólidos a temperatura ambiente, apresentam brilho metálico e quando expostos ao ar oxidam facilmente. São utilizados na iluminação no caso das lâmpadas de sódio, na purificação de metais e na fabricação de sabões sendo combinados com a gordura.
Grupo 2: Metais alcalino-terrosos: Possuem esse nome por serem geralmente encontrados na terra. São bastante reativos, porém menos que os metais do grupo 1. Também são eletropositivos e são mais duros e densos do que os metais alcalinos. São utilizados em ligas metálicas como é o caso por exemplo do Berílio (Be), na composição do gesso e do mármore sendo o caso do cálcio (Ca) e em fogos de artifício magnésio (Mg) e estrôncio (Sr).
Grupo 16 (ou 6A): Calcogênios: Os elementos desse grupo recebem esse nome derivado do grego que significa “formadores de cobre”. Neste grupo pode-se perceber facilmente analisando todos os elementos do grupo a presença de características metálicas e não metálicas. Os elementos mais importantes deste grupo são o oxigênio (O) e o enxofre (S) sendo o primeiro o gás utilizado inclusive em nossa respiração e o último é responsável inclusive pelo fenômeno da chuva ácida.
Grupo 17 (ou 7A): Halogênios: São os elementos mais eletronegativos da tabela periódica, ou seja, possuem a tendência de receber elétrons em uma ligação. Podem se combinar com quase todos os elementos da tabela periódica. O flúor por exemplo possui aplicação na higiene bucal.
Grupo 18 (ou 8A): Gases nobres: possuem essa intitulação devido a ser constatado antigamente que não possuíam tendência alguma a formarem ligações. Isto ocorre devido à estabilidade de seus orbitais da camada mais externa completamente preenchidos. Hoje alguns compostos conseguiram ser preparados com estes elementos e incluem geralmente o Xenônio (Xe) que possui a primeira energia de ionização muito próxima do oxigênio.



Sem comentários:
Enviar um comentário